Av Dagfinn Rosnes 06.01.18
Kort om dyrkning av mikroorganismer
Et av de største fremskrittene for menneskeheten og medisinfaget i løpet av det 19. århundre, var Robert Kochs utvikling av metoder for å kunne dyrke og isolere mikroorganismer. Man hadde kjent til at det eksisterte mikroorganismer helt siden Leeuwenhoeks publikasjon i 1677 (Leeuwenhoek, 1677), men det var først med Louis Pasteur og Robert Koch at man innså nytteverdien av kunnskap om denne mikrofloraen, både ved å forstå at sykdom fremkalles gjennom patogener, og at fermentering skyldes mikroorganismer som må tilsettes (eller allerede være til stede) i most eller vørter ved tilvirkningen. Ved å utvikle metoder for å kunne fremdyrke levende mikroorganismer i et laboratorium, kunne man øke sin forståelse for hvordan disse organismene lever, og hvordan de utøver sine funksjoner. I 1881 presenterte Robert Koch en metode for å dyrke levende cellekulturer på et fast medium (Blevins, 2010), og fra da av, utviklet vi vår forståelse for mikrobiologien i et rasende tempo. Fra disse første vellykkede forsøkene på å isolere mikroorganismer, til James Watson og Francis Crick presenterte sin oppdagelse av DNA-molekylet i 1953 (Watson and Crick, 1953), gikk det bare 75 år. Med Ignaz Semmelweiss og Joseph Listers utvikling av aseptiske og sterile teknikker, var grunnlaget for moderne medisin, og moderne fermentering lagt.
Prinsippet bak isolering av mikroorganismer er svært enkelt. Man lager en næringsløsning som inneholder de nødvendige næringsstoffer og energikilder mikroorganismer trenger, tilsetter noe som får den til å stivne, steriliserer, og lar den kjølne, før man stryker ut et tynt lag av kulturen med organismen man ønsker å isolere. Denne settes så i en inkubator. Etter et gitt tidsrom kan man ta vekstmediet ut av inkubatoren og se hva som vokser på det. Ofte vil man finne at det er flere forskjellige organismer som har vokst frem. Om man klarer å identifisere den organismen man ønsker å isolere, kan man skrape ut noen kolonier av denne, og dyrke på nytt, helt til man har en kultur som er ren for andre organismer. Man kan selvsagt også tilsette stoffer i vekstmediet som hemmer veksten av uønskede organismer, eller som bare et svært selektivt antall organismer kan vokse på. Dette kalles henholdsvis selektive og differensierende media. Dette har imidlertid liten praktisk nytte for den bruk som her skal beskrives.
For å sikre seg at gjæren man bruker alltid er sunn og frisk, bør man – om man gjenbruker gjær – fra tid til annen sørge for at gjæren oppfyller to basale kriterier. Én – at gjærkulturen er frisk, velernært og består overveiende av levende celler, og to – at cellekulturen ikke er kontaminert med noe som ikke skal være der, enten det er bakterier, virus, humlerester, proteinøst bunnfall, eller annen forurensning. Man kan gjøre mange grep for å holde kulturen velernært og fri fra kontaminasjon, men bruker man en gjærstamme over tid, risikerer man at den svekkes, både gjennom forurensende elementer, eller gjennom mutasjoner som følge av dårlig ernæringsstatus og stress. Mye forurensning kan man forebygge ved å ta av en mindre mengde gjær før man brygger, og dyrke nye kulturer fra denne – altså at man ikke høster gjær fra fermenteringstanken etter endt forløp. Dette sikrer dog ikke at kontaminering ikke kan skje. Når man har brukt en gjærstamme over tid, bør man sikre seg at den ikke inneholder noe annet enn den skal gjøre, og man bør sikre seg at den er frisk og sunn. For å oppnå dette, kan man dyrke kolonier av gjæren på et fast medium, og derved isolere rene cellekolonier som kan dyrkes opp videre. Jeg skal i det følgende forsøke å vise hvordan man kan isolere gjær, og hvordan man lager dyrkningsplater med adekvat næring. Den leser som kjenner litt til hvordan man dyrker levende cellekulturer i et laboratorium, kan hoppe over den neste seksjonen.
Hva trenger man?
Man trenger ikke så veldig mye utstyr for å isolere gjærkulturer, men noe må man gå til anskaffelse av. Det aller viktigste er å kunne jobbe med dyrkningen på et sted der man kan minimere muligheten for at kulturen man vil isolere blir kontaminert av noe. Ideelt skal arbeidet skje i sterile omgivelser. I et vanlig hjem er dette tilnærmet umulig å få til, men man kan med litt nøyaktighet og gode forberedelser fint klare lage en aseptisk sone man kan jobbe i. Dette medfører litt større sjanse for å mislykkes, men er man nøyaktig og metodisk, går det som oftest bra.
Utover et sterilt/aseptisk område, trenger man:
- En kolbe eller et stort reagensrør til dyrkning i flytende medium
- Petriskåler til å dyrke isolasjonskulturen i
- En trakt (90 mm. glasstrakt er ideelt)
- Filterpapir
- En inokulasjonsloop
- Agar
- Næringsmidler til bruk i vekstmediet
- En bunsenbrenner eller annen ikke-sotende varmekilde med åpen flamme
- Inkubator eller varmeskap
- Desinfeksjonssprit (anbefaler Antibac overflatedesinfeksjon 75%)
- Sterile duker
- Hansker, munnbind, og eventuelt labfrakk
- Autoklav eller trykkoker (stekeovn kan brukes. En autoklav er en industriell trykkoker designet for sterilisering av utstyr)
- Aluminiumsfolie
- Inkubator/varmeskap
Hvordan lager man vekstmediet?
Det er mange ulike måter å lage et fast vekstmedium på, men her skal vi gjøre det enklest mulig. Det vi ønsker å oppnå, er å lage en fast «såle» av næringsrikt materiale som gjæren kan vokse på. Dette oppnår vi gjennom å lage en flytende næringsløsning, som ved høy varme tilsettes et stoff som får løsningen til å stivne når den kjøles ned. Dette er ikke helt ulikt å lage gelé eller fruktgrøt. Gjennom tidene har man brukt mange ulike løsninger. Gelatin har mange av de riktige egenskapene, men har en tendens til ikke å bli fast nok i de temperaturer man bruker til dyrkning. Dessverre er det også slik at en del mikroorganismer kan fordøye gelatin. I dag bruker man agar til formålet. Dette ble oppdaget i 1882 av Angelina Hesse, som var gift med Walther Hesse – en av Robert Kochs medarbeidere. Hun var klar over problemene ved bruk av gelatin, og foreslo agar, som hun hadde lært om som ingrediens i matlaging av et nederlandsk ektepar de kjente. Disse hadde bodd i Indonesia, hvor agar ble brukt som fortykningsmiddel i matlaging. Fordelene med agar ble raskt åpenbare. Ved tilsetning av så lite som 2% agar, får man et helt solid substrat som solidifiseres ved32-40 0C, ikke fordøyes av mikroorganismer, og holder seg stiv til opp mot 65 0C. Agar er et polysakkarid som utvinnes fra gellidium-algen, og er i bruk både som vekstmedium for mikroorganismer i laboratorier, så vel som i det asiatiske kjøkken.
For vårt formål, skal vi lage en helt enkel næringsløsning med agar. Gjærsopper vokser helt utmerket på PDA – Potet-Dextrose-Agar. Denne består av en infusjon av potet, tilsatt glukose (dextrose er det samme som glukose) og agarpulver. Om man vil, kan man tilsette en liten mengde gjærnæring, men det er strengt tatt ikke nødvendig. Hold det enkelt, og bruk heller gjærnæring når du skal dyrke opp den isolerte gjærstammen. PDA-løsningen lager du slik:
Potet-dextrose-agar:
50 g. revet, uskrellet potet
250 mL destillert vann (Batterivann kan også brukes, f. eks. fra Biltema)
5 g. glukose
5 g. agar
Den revne potetmassen kokes i vannet i 30 minutter, og skal deretter filtreres to ganger. Gjør dette mens væsken er varm. Væsken du sitter igjen med etter to filtreringer vil være litt uklar, men skal ikke inneholde synlige partikler. Ikke bruk samme filter to ganger. Om man vil være ekstra nøye, kan man gjerne bruke et sprøytefilter på 0.45 ?m, men dette er helt unødvendig om du ikke har synlige partikler i løsningen. Til dette tilsettes glukose, og til slutt agar. Rør godt til alt er løst opp. Denne løsningen skal nå steriliseres. Har du en autoklav eller trykkoker er dette enkelt (husk at korken ALDRI må skrus til i denne prosessen!) – hvis ikke kan du sette den i stekeovn på 130 0C i 30 minutter – men da må løsningen være bragt til kok først (samme tid for autoklav/trykkoker). Husk å dekke til åpningen på beholderen du bruker. Dette kan være en erlenmeyerkolbe eller en autoklaverbar labflaske. Bruker man en erlenmeyerkolbe, kan man dekke åpningen med aluminiumsfolie.
Når flasken med agarløsningen er sterilisert, begynner den delen av prosessen hvor man må være ekstremt nøye med hygiene. Bruk hansker! I et laboratorium, kan man sette flasken til kjøling i et avtrekkskammer med et HEPA-filter, og dermed redusere kontaminasjonsrisikoen til et absolutt minimum. De færreste har slikt utstyr hjemme. I første rekke skal løsningen nå kjøles til ca. 50 0C. Agaren vil begynne å stivne ett eller annet sted under denne temperaturen. Som regel mellom 32 – 40 grader, men det er greit å ha litt tid på seg, særlig hvis man skal fylle mange skåler. Man må følge nøye med på temperaturen, slik at agaren ikke stivner før den er helt i petriskåler. Hvis man vil slippe å følge med kontinuerlig, kan man sette flasken i et vannbad som holder 55 0C, dersom man har mulighet til å kontrollere temperaturen slik. Før vi beskriver fylling av petriskål, skal vi se litt nærmere på hvordan skålene forberedes.
Petriskål – sterilisering og praktisk håndtering
Petriskålen er opprinnelig en beholder bestående av to glasskåler, der den ene har litt større diameter enn den andre, og dermed fungerer som lokk. Disse skålene har navn etter Julius Petri, et av medlemmene i Robert Kochs team. Petriskåler fåes både i plast og glass, og med varierende diameter. Til isolering av gjær, vil jeg anbefale 90 mm. Plastskåler er vanskelige å sterilisere, og jeg anbefaler ikke å bruke slike med mindre man får anskaffet dem ferdig sterilisert i individuelt pakkede, sterile poser (ikke kjøp slike fra billige ebayforhandlere). Glasskåler er litt dyrere, men er enkle å sterilisere, og kan gjenbrukes uendelig antall ganger, så lenge de ikke har skår og hakk. Glasskåler kan man gjerne kjøpe fra ebay, men vær oppmerksom på at ikke alt du får tak i der er like varmebestandig eller solid som det hevdes. Før sterilisering, bør man forsikre seg om at skålene er ordentlig rene, og at de ikke inneholder partikler eller smuss som kan forstyrre dyrkningsprosessen. Har man en autoklav (det er det vel ikke mange som har hjemme?) eller en trykkoker, er steriliseringsprosessen enkel. Har man ikke slikt utstyr, kan man bruke en stekeovn. Fremgangsmåten er som følger (vask hendene godt, ta på hansker, og vask med sprit):
- Pakk skålene i aluminiumsfolie, slik at det ikke er noe åpning i folien (skålene skal være lukket – det har ingen hensikt å sterilisere bunn og lokk separat, og dette gir bare større sjanse for kontaminasjon når du skal håndtere dem etterpå.
- Legg disse pakkene i stekeovn på 125 0C, og la dem ligge der i minst 30 minutter (Ved autoklavering bruker man 121 0C med damp under trykk i 30 minutter).
- Ta pakkene med petriskåler ut etter endt sterilisering, og legg dem på et desinfisert (helst sterilt) underlag. Ikke åpne dem før du skal fylle skålene. Fra de er kalde, må du bruke hansker når du håndterer dem.
Hvor mange skåler trenger man? Det kan variere, men jeg anbefaler at man bruker et minimum av fire skåler. De første gangene man gjør dette, er risikoen for kontaminering ekstra stor, og derfor kan det være lurt å lage så mange plater som mulig, slik at man får færrest mulig kontaminerte dyrkninger. Med erfaringen, kommer bedre teknikk og bedre oversikt over mulige feilskjær og feller.
Hvordan sikre et (mest mulig) sterilt arbeidsområde?
I et vanlig hjem er det nesten umulig å få til arbeidsforhold som blir helt sterile, men det er mange grep man kan gjøre for å tilnærme seg dette. Man bør søke å gjøre arbeidsområdet fritt for, og utilgjengelig for mikroorganismer.
I et laboratorium har man et tilnærmet helt kontrollert miljø, der både temperatur og trykk kontrolleres, og der man har kontrollmekanismer for å hindre partikler og mikroorganismer i luften fra å komme forstyrrende inn i arbeidet man gjør. Rengjøringsprosedyrene er selvsagt også helt annerledes enn i et vanlig hjem. I mangel av dette, kan man dog gjøre mye for å forhindre uønskede hendelser.
Først og fremst bør man jobbe i et rom som er lett å rengjøre skikkelig, og som ikke inneholder for mange elementer som kan samle støv, mugg- og soppsporer, etc. Med andre ord – sørg for en ren og ryddig bordplate i et rent rom, og vær i størst mulig grad den eneste som har adgang til rommet mens du jobber med sterile prosedyrer. Husk at bryggeutstyr kan inneholde mikroorganismer du ikke ønsker at skal finne veien ned i petriskålene dine. Vask arbeidsbenken din med sprit før du begynner (på apoteket kan du kjøpe antibac overflatedesinfeksjon. Denne inneholder 75% etanol (uten glyceroltilsetning, så ikke bruk den som håndsprit), og er effektiv til rengjøring av flater). Du kan med fordel bruke en steril duk å jobbe på, siden de fleste bordplater har hakk og fordypninger på mikronivå, som kontaminerende elementer kan gjemme seg i.
Hvis man er nøye med alt det ovenstående, er den største kontaminasjonsrisikoen at det kommer mikropartikler fra luften ned i kulturen mens man jobber. I laboratoriene bruker man derfor avtrekkskamre med et HEPA-filter for å unngå dette. I et vanlig hjem, kan man minimere denne risikoen gjennom å jobbe i et felt med en stigende luftsøyle rundt. Her kan du bruke bunsenbrenneren jeg nevnte i listen over utstyr. Det kan være lurt å sette et par varmekilder til rundt arbeidsområdet ditt. Her kan du være kreativ, men spritbrennere eller telys fungerer fint. Når du jobber innen dette feltet, må du huske at de objektene du jobbermed ikke må flyttes ut av området der luften stiger. Bruk munnbind, for å forhindre at du puster bakterier fra munnhulen ned i kulturene dine. En labfrakk kan være grei å ha på seg, men er ikke strengt tatt nødvendig. Hvis du bruker sprit til å rense noe underveis – pass på at du ikke bruker dette i nærheten av åpen flamme.
Tilvirkning av agarplater – fylling av skålene
Når agarløsningen har kjølt til 50 – 55 0C, skal den fylles i skålene. Sørg for at ditt sterile arbeidsfelt er etablert, vask hendene godt, og desinfiser dem med sprit. Ta på deg sterile hansker (eller vask hanskene med sprit når du har tatt dem på – husk igjen at sprit og åpne flammer er en dårlig kombinasjon. Sikkerhet er viktig). Sørg for at du har alt du trenger foran deg på bordet, slik at du ikke må sterilisere hender og utstyr igjen hver gang du skal hente noe.
Hent nå pakkene med steriliserte petriskåler, legg dem i arbeidsområdet ditt, og pakk forsiktig ut. Den smaleste halvdelen av skålen (=minste diameter) er bunnen, og det er denne du skal fylle løsningen i. Pass på å holde alt innenfor arbeidsfeltet ditt, og fyll bunnen av hver skål mellom halv- og 2/3 full. Ikke sett på lokkene. Da vil det dryppe kondens ned på platene, og du får ikke noen jevn overflate til gjærkulturen din. Bare legg lokkene slik at de hviler på kanten av bunnen, og legg steril aluminiumsfolie over mens platene kjølner. Pass på at platene blir godt dekket, men at folien ligger løst nok til at det ikke drypper kondens ned i dem. Eventuelt kan du la varmekildene dine brenne mens de kjølner, slik at du minimaliserer sjansene for kondens. Ingen av disse løsningene er helt optimale, men med erfaring, vil man få det greit til (et lukkbart avtrekkskammer har sine absolutte fordeler).
Agarplatene vil begynne å stivne rundt 40 0C. Når de er nådd romtemperatur, er agaren stabil nok til at du kan begynne å inokulere – å stryke ut gjæren du vil isolere.
Forberedelse til inokulasjon
Mens platene kjølner, henter du frem gjærkulturen du vil isolere (hvis du vil slippe en ekstra runde med sterilisering av hender, hansker etc, kan du gjøre dette klart på forhånd, men det blir litt ventetid mens platene kjølner). GJærkulturen bør ha stått kjølig i ca. ett døgn før du skal bruke den, slik at all gjæren er bunnfelt. Dekanter forsiktig av overskuddsvæsken, og hell en mindre mengde gjærslurry over i en liten beholder – reagensrør eller noe slags lite glass. Det er veldig lite gjær du trenger – mye mindre enn du tror. En beholder på 1.5 – 10 mL holder i massevis. Grunnen til at du skal dekantere av overskytende væske, er at du skal klare å hente ut gjær på inokulasjonsloopen din uten at dette skylles av når du løfter den opp av gjærsuspensjonen. Husk at det du heller gjæren opp i må være desinfisert. Siden vi skal isolere gjæren, behøver ikke denne beholderen å være absolutt steril, men vi vil ikke tilføre flere organismer eller fremmed «slagg» enn vi strengt tatt allerede har i slurryen.
Inokulasjon – utstryk av gjær på platene
Når agarplatene har kjølnet, er det på tide å inokulere dem med gjæren som skal isoleres. Inspiser platene (husk desinfisering, munnbind og hansker, og hold alt innenfor arbeidsfeltet). De skal nå være helt faste, med en jevn overflate. Forkast eventuelle plater som inneholder bobler eller lignende (man kan prøve å sprekke boblene ved å føre skålen raskt gjennom flammen i en bunsenbrenner. Ikke bruk stearinlys eller spritbrennere til dette. De soter!). Bobler på overflaten kan “poppes” med en inokulasjonsloop som er varmet opp til den er rødglødende. Merk at det er lurt å heller vente for lenge enn for kort. Å begynne å røre på petriskåler med agar som ikke er tilstrekkelig stiv er ikke særlig formålstjenlig.


Finn frem okulasjonsloopen, en skål med agar, og beholderen med gjærslurry. Hold skålen slik at den hviler på fingertuppene og tomlen. Med den andre hånden stikker du løkken på inokulasjonsloopen inn i flammen på bunsenbrenneren til den er rødglødende. Selve løkken er nå steril. Kjøl den kort ved å berøre agaren langsmed siden av skålveggen (du kan også ha et rør med sterilt, destillert vann å dyppe den i, men dette medfører ytterligere risiko for kontaminasjon hvis du ikke er uhyre nøyaktig). Deretter dypper du den i gjærslurryen. Trekk loopen opp av gjæren igjen. Du trenger ikke å anstrenge deg for å få med mest mulig gjær, da det er mer enn nok celler som blir med loopen opp (og du vil ikke ha for tykt utstryk på platen). Deretter stryker du loopen i en side til side-bevegelse langs kanten av agarplaten slik:
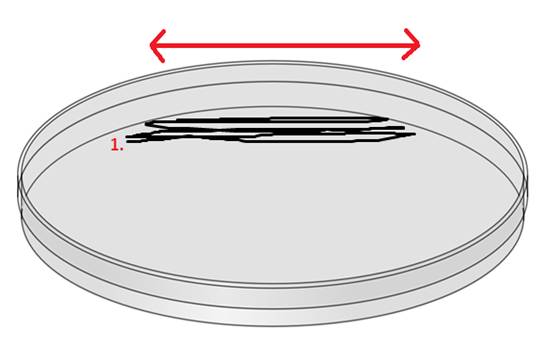
Etter dette første inokulasjonssteget, er alt klart for at gjærcellene kan begynne å vokse på næringen i agarplaten. Imidlertid vil også alt mulig annet som måtte befinne seg sammen med gjærcellene også kunne nyttiggjøre seg næringen til å vokse og potensielt få overtaket (muggsopper som forekommer naturlig i alle hjem er en reell risiko. Derfor laget vi et felt med stigende luft rundt arbeidsområdet, slik at disse ikke kan falle ned på platen under inokuleringen). Dette ønsker vi ikke, da siktemålet er å isolere en ren gjær.For å sikre at vi kan hente ut isolerte kolonier, skal vi derfor gjøre tre utstryk til. Disse gjøres fra det første utstryket. Du trenger derfor ikke hente mer gjær fra kulturen du hadde.
Mens du fortsatt holder skålen i hånden, steriliserer du loopen igjen i flammen fra bunsenbrenneren (husk å kjøle den før du stryker videre). Stryk nå på samme måte som i forrige steg, men 90-130 grader på tvers av forrige utstryk, slik at du tynner ut antall celler i det nye utstryket.
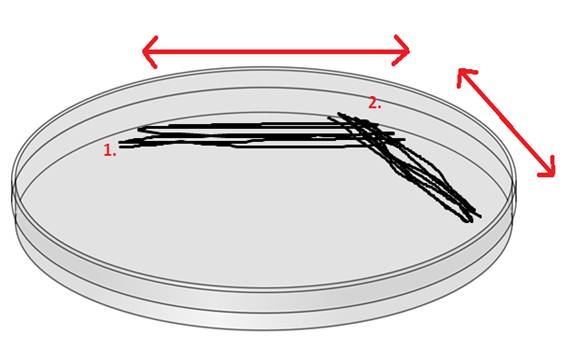
Sterilisér igjen loopen i flammen, kjøl den, og gjør et tredje utstryk på samme måte som i steg 2:
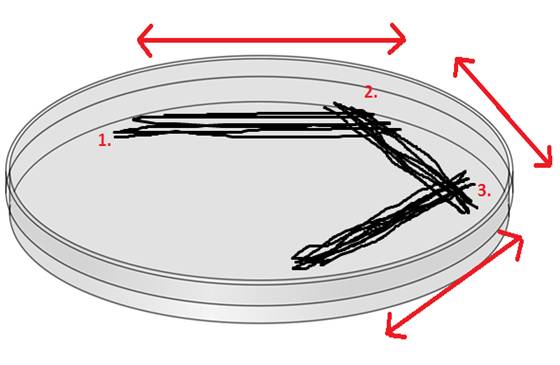
Nå kommer det siste og viktigste steget, og det er fra den fjerde utstrykningen du skal hente dine isolerte kolonier. Steriliser loopen i flammen igjen, kjøl den, og trekk så fra tredje utstryk i et sikksakk-mønster inn mot midten av platen. Her skal du ikke stryke frem og tilbake, men bare stryke én enkelt gang. Om du nå har gjort alt riktig, vil det vokse individuelle kolonier langs med denne siste aksen.
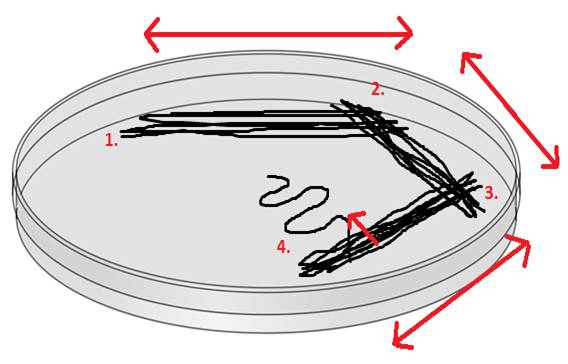
Mens du fortsatt holder skålen inne i arbeidsfeltet, setter du nå lokket på, og snur platen opp-ned. Grunnen til at den skal stå opp-ned, er at vi ønsker å forhindre at kondens drypper fra lokket og ned på koloniene. Merk skålen med dato og hvilken gjærstamme den inneholder. Selv om du bare isolerer én gjærstamme, bør du være nøye på merking. Gode arbeidsvaner gjør at du slipper mye fortvilelse senere, når du kanskje jobber med flere prosjekter samtidig.
Gjenta så prosessen for alle skålene du har fylt. Nå er det på tide å gi gjæren gode vekstforhold.
Inkubasjon
Nå som agarplatene er inokulert, skal gjæren få lov til å vokse. Saccharomyces har et veksttemperaturspektrum fra 1 – 3 0C til 40 0C, og optimale vekstbetingelser mellom 25 – 30 0C For å kunne høste friske, isolerte kolonier, skal petriskålene nå inkuberes i 24-48 timer. Til dette trenger man en inkubator. Dette er et varmeskap som sikrer stabil temperatur, ikke ulikt et gjæringsskap. Dersom man ikke har behov for å kunne kontrollere trykk og CO2/O2-metning, kan man enkelt bygge en selv, med en temperaturisolert boks, en varmekilde og en PID. Imidlertid må man i utformingen huske på at den bør være lett å sterilisere. Sett petriskålene i inkubatoren, og la dem stå i 24-48 timer. Skålene skal stå opp-ned, for å forhindre at kondens fra agaren drypper ned på vekstmediet. Temperaturen bør være i den optimale sonen, men det er ikke problematisk, om man ikke kommer utenfor tåleevnen. Dog skal man ta med i betraktningen at prosessen vil gå veldig langsomt om temperaturen er i den nedre enden av spekteret. I ekstremene vil gjæren gå inn i termisk sjokk, og gjærceller vil begynne å dø. I prinsippet kan man gjerne la skålene stå i romtemperatur, og man vil få god vekst. Imidlertid bør de da ikke stå åpent fremme, ettersom det vil øke faren for kontaminasjon. Om man velger å ikke bruke inkubator, bør skålene dekkes til. En inkubator gir jevn temperatur, og vil gi mer forutsigbare resultater, samt at feilsøking vil være lettere om resultatet ikke er vellykket.
Isolering og oppdyrkning
Når inkubasjonsperioden er over, tar man petriskålene ut, og observerer resultatet. Husk stadig på steril/aseptisk prosedyre, og bruk hansker og munnbind. Jobb i et sterilt felt, slik som beskrevet tidligere.
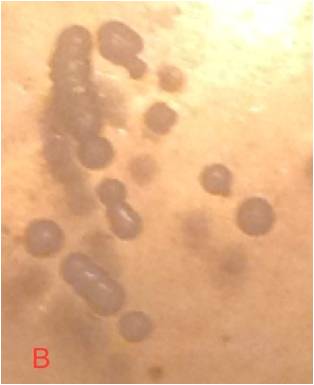
Platene bør nå vise en jevn vekst av hvite, runde kolonier, og isolerte kolonier bør kunne sees mot midten av platen. Dersom noe er hårete, misfarget eller danner mistenkelig store kolonier, er sannsynligheten for kontaminasjon stor. Da kan det være greit å høste noen isolerte kolonier som dyrkes opp på en ny agarplate, dersom kontaminasjonen er stor.
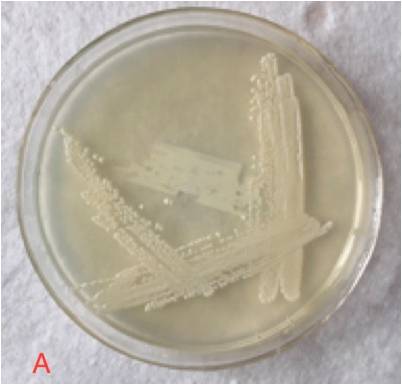

For å høste isolatet, bruker man igjen loopen. Forbered et flytende vekstmedium på 10-15 mL 10% DME (dette gjør du slik som når du lager en vanlig starter. Det må naturlig nok, kokes). Dette vil gi en spesifikk vekt på 1.038 (Vil man være helt pedantisk, løser man opp 1.038 g. i 10 mL destillert vann for å oppnå en gravitet på 1.040, men så nøyaktig er det ikke nødvendig å være. 1 g pr. 10 mL vann er nøyaktig nok). Et reagensrør (15-20 mL) er veldig praktisk til dette.
Etablér igjen et sterilt felt å jobbe i, slik som tidligere beskrevet. Sterilisér loopen i flamme slik som tidligere. Husk å kjøle før du høster kolonier (og selvsagt husker man munnbind og hansker). For å høste den isolerte gjæren, velger man seg ut 4-5 isolerte kolonier. Loopen skal steriliseres for hver gang du plukker en koloni. Måten man høster dem på, er ved å legge løkken ytterst på loopen over den kolonien man vil høste, trykke den lett ned slik at kolonien blir liggende inne i løkken, og deretter trekke loopen lett til seg, slik at kolonien løsner fra agarplaten (ikke noe av dette krever noen særlig kraft). Kolonien vil nå kunne løftes opp fra platen. Før loopen med den isolerte kolonien ned i næringsløsningen i reagensglasset, og rør rundt et par ganger slik at gjærcellene havner i suspensjon. Sterilisér loopen i flammen igjen og gjenta. 4 – 5 kolonier er rikelig. Å høste flere kolonier øker risikoen for kontaminasjon.
Når man har høstet det ønskede antall kolonier og suspendert dem i væsken, lukker man reagensrøret med (sterilisert) aluminiumsfolie eller lignende, og lar gjæren formere seg i løsningen. Agitér røret lett, slik at du rister litt oksygen inn i suspensjonen. Dette er akkurat det samme som en starter, bare i meget lite format. Om du har en inkubator, kan du gjerne sette røret i den, for raskere vekst. Om man har mulighet til det, kan røret gjerne settes i 450 vinkel, slik at man får litt større overflate i kontakt med oksygenet i luften. I løpet av relativt kort tid vil man se fermenteringsaktivitet, og det bør komme bunnfall etter det første døgnet. Herfra kan man skalere opp gradvis til en normal starter om man skal bruke gjæren til et brygg, eller opp til man har et frysbart volum, dersom man lagrer gjær i fryser. Etter den første 10-mL kulturen, kan det være fornuftig å gå opp til 100 mL, la dette fermentere, deretter opp til 200, og til slutt 500 mL. Herfra bør man ha en gjærmengde man kan sette en normal startkultur på. Man kan spørre seg om det er like greit å sette en vanlig starter med en gang, uten disse trinnene med redusert volum. Det kan man selvsagt, men da må man regne med at man bruker en del tid på å lure på om fermenteringen egentlig er kommet i gang, siden det svært beskjedne cellevolumet vil bruke en del tid på å komme opp i mengder der aktiviteten blir synlig. I tillegg er det en viss risiko for kontaminasjon, siden gjæren vil bruke lang tid på å danne tilstrekkelig volum til å bli den dominerende mikroorganismen i mediet, dersom man har vært uheldig eller unøyaktig. Jeg vil ikke anbefale å dyrke frem noen få kolonier i et normalt startervolum.
Oppsummering
Isolering av gjær er ikke spesielt vanskelig, men krever nøyaktighet og planlegging. For den som er uerfaren med laboratoriearbeid, kan det ovenfor beskrevne fortone seg som pedantisk, tidkrevende og strevsomt. Jeg anbefaler at man tillater seg å være pinlig nøyaktig de første gangene man gjør dette, så vil man med erfaring, prøving og feiling finne ut hvor man kan kutte i svingene, og finne en prosedyre som fungerer godt for å tilfredsstille egne behov. Så lenge man er nøye med hygienen, er dette ikke vanskelig, men det krever tålmodighet. De vanligste feilene man kan gjøre (foruten å undervurdere kontaminasjonsrisikoen når man slurver med sterilisering i ett eller flere ledd), er å vente for lenge med å helle agarløsningen i skålene, glemme å sterilisere loopen i arbeid med platene, og å stryke gjærsuspensjonen for tykt over platene. Husk at du bare skal hente gjær fra slurryen én eneste gang når du inokulerer platene dine. De tre neste utstrykene skal gjøres fra gjærceller som allerede er på platen. Jeg bemerker her at det finnes flere måter å stryke ut plater på, og den her beskrevne er ikk eneste mulighet. Imidlertid forsøker vi å gjøre det så enkelt og praktisk som mulig. Det står en hver fritt å oppsøke andre kilder, og kanskje finner man en annen utstryksteknikk man opplever bedre resultater med. Med erfaring kommer mye på plass, og man behøver ikke å låse seg til én teknikk.
Hvis man opplever at agaren er blitt klumpete når den skal helles i skålene, må den forkastes. Å forsøke å bruke en agar som har begynt å stivne før den er helt i petriskål, skaper bare frustrasjon og trøbbel. Man kan prøve å varme den opp igjen, men jeg anbefaler det ikke. Lag heller en ny løsning, så har du bedre kontroll. Når skålene er fylt, vent heller for lenge enn for kort med å inspisere agarplatene. Beveger du på skålene før agaren er stivnet, kan du få en ujevn overflate som ikke lar deg isolere noe som vokser på den. Ikke glem at platene skal inkuberes opp-ned, slik at kondens fra agarplaten ikke samler seg i lokket og drypper ned på kulturen din.
Å dyrke og isolere gjær på fast medium er en ferdighet som må øves litt på – men mestrer man teknikken, kan den være uhyre nyttig og besparende. Om man i tillegg har mulighet til å kryopreservere (fryse) gjæren, kan man i prinsippet være selvforsynt med gjær nærmest i det uendelige. Noen begrensninger finnes selvsagt, men det vil man finne ut av etter hvert som man utvikler sine teknikker og prosedyrer.
Helt til slutt legger jeg ved noen linker med utfyllende informasjon om mikrobiologiens og dyrkningens historie. Dette er ikke så direkte relatert til våre gjærstammer, men kan være interessant for den vitebegjærlige, som ønsker å vite mer om hvordan vår forståelse av mikroorganismer er vokst frem, og litt om hvilke teknikker man bruker og har brukt for å kultivere og studere dem.
- https://www.labnews.co.uk/features/history-of-the-agar-plate-01-11-2005/
- https://profiles.nlm.nih.gov/ps/access/bbabon.pdf
- https://thebiomedicalscientist.net/science/big-story-petri-dish
Referanser:
Leeuwenhoek A: Observations, communicated to the publisher by Mr. Antony van Leeuwenhoek, in a dutch letter of the 9th Octob. 1676. Here English’d: concerning little animals by him observed in rain-well-sea- and snow water; as also in water wherein pepper had lain infused Phil. Trans. 1677 12, 821-831, published March 1677
Blevins SM, Bronze MS. Robert Koch and ‘golden age’ of bacteriology Int J Infect Dis 2010 Sep;14(9):e744-e751
Watson JD, Crick FHC Molecular structure of nucleic acids: A structure for deoxyribose Nucleic Acid Nature 171, 737-738 (25 April 1953)
Bilder og illustrasjoner er laget av forfatteren, og er ikke i konflikt med noen opphavsrett. Malen til illustrasjonen av petriskålene i fig. 1 – 4 er hentet fra https://pixabay.com/no/petrisk%C3%A5l-glass-vitenskap-agar-agar-149007/ og er fri for kommersiell bruk under CC0 Creative Commons
En stor takk rettes til norbryggforumets medlemmer msevland, LarsUlv og AndyHagen. Takk for konstruktive kommentarer og innspill.
